|
Aufbau der Materie ATOMMODELL LADUNGSTRÄGER, ELEMENTARLADUNG |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Atome sind bekanntlich die kleinsten Bausteine der Elemente, von denen man heute ca. 100 kennt. Elemente sind z. B.: Aluminium, Kupfere, Silber. Der Aufbau des Atoms wird hier nur insoweit besprochen, wie es für das Verstehen der Vorgänge in der Elektrotechnik notwendig ist.
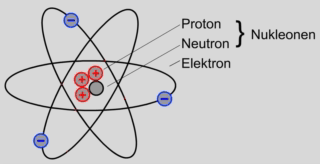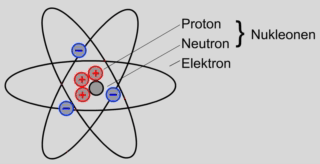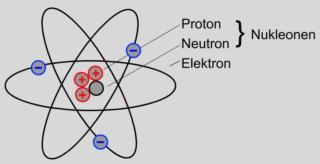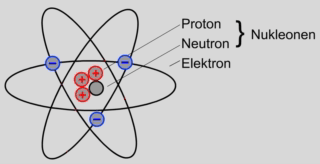
Nukleonen
Das Atom besteht aus dem Atomkern und der Atomhülle.
Der Atomkern selbst besteht aus zwei unterschiedlichen Elementarteilchen:
Den Protonen und den Neutronen. Diese werden als Nukleonen bezeichnet.
Protonen sind positiv elektrisch geladen.
Neutronen sind elektrisch neutral.
In der Atomhülle bewegen sich die sogenannten Elektronen um den Atomkern.
Elektronen sind negativ elektrisch geladen.
![]()
Die elektrischen Ladungen von Proton und Elektron sind gleich groß und heben einander nach außen auf.
Das gesamte Atom ist nach außen hin elektrisch neutral.
Es gilt deshalb die Regel:
Zahl der Elektronen in der Hülle = Zahl der Protonen im Kern.
Das Atommodell erinnert uns an die Sonne und ihre Planeten:
Ähnlichkeit
mit
Sonnen-
system
Vereinfachtes
Atommodell
nach Neals Boor
und
Rutherford
Aufbau eines Wasserstoffatoms:
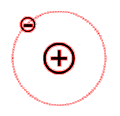
Vereinfachte Darstellung
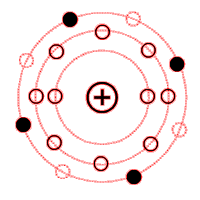
Atommodell eines Lithium Isotops
Die Elektronen bewegen sich auf unterschiedlichen Bahnen
Anzahl der Protonen
bestimmt
das
Element
Aluminiumatom 13 Elektronen 13 Protonen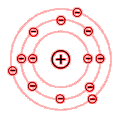
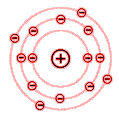
Siliziumatom 14 Elektronen 14 Protonen
Chem.
Verhalten
Valenzelektronen:
Wie aus den beiden Beispielen des Aluminium- und Siliziumatoms zu erkennen ist, sind die Elektronen auf verschiedene Schalen verteilt.
Für das chemische Verhalten eines Stoffes sind die Elektronen der äußersten Schale maßgebend. Diese Elektronen bestimmen die chemische Wertigkeit eines Stoffes und werden deshalb als Valenzelektronen bezeichnet (Valenz = Wertigkeit).
Die Elektronen der äußersten Schale bezeichnet man als die Valenzelektronen.
Silizium-
atom
Wichtig
für
Halbleiter!
|
Siliziumatom
14 Protonen
14 Elektronen |
|
|
Die äußerste Schale wäre mit 8 Elektronen vollbesetzt. (Edelgaszustand) |
|
|
Valenzelektronen |
||
|
|
Leere Plätze auf den "Edelgaszustand" |
(Wandern)
Gibt z. B. ein Siliziumatom ein Elektron ab, so überwiegt
die Anzahl der Protonen im Kern und somit die positive Ladung:
(14 Protonen, 13 Elektronen).
Überwiegt die Anzahl der Protonen ist das Atom ist ein positives Ion.
Nimmt das Atom ein Elektron von einem
anderen Atom auf, dann überwiegt die negative Ladung:
(14 Protonen, 15 Elektronen).
Überwiegt die Anzahl der Elektronen ist das Atom ist ein negatives Ion.
Lehrwerkstätte / Elektrotechnik / Kap. 1 / 2